
- Müəllif Miles Stephen [email protected].
- Public 2023-12-15 23:33.
- Son dəyişdirildi 2025-01-22 16:56.
In almaz valent elektronlar tam kovalent bağlıdır. Amma in qrafit bir elektron sərbəst hərəkət edərkən yalnız üç kovalent bağlanır almazın ərimə nöqtəsi olmalıdır ondan daha yüksək ki, qrafit çünki içində almaz içində olarkən dörd kovalent bağı qırmalıyıq qrafit yalnız üç istiqraz.
Üstəlik, niyə qrafitin ərimə nöqtəsi almazdan aşağıdır?
In qrafit , hər bir karbon atomu kovalent bağlarla digər üç karbon atomu ilə əlaqələndirilir. In almaz hər bir karbon atomu dörd digər karbon atomu ilə kovalent bağlarla bağlıdır. Ona görə də paradoksal görünür almaz olacaqdı aşağı ərimə nöqtəsi . Bununla belə, təbəqələri qrafit delokalizasiya olunmuş elektronları ehtiva edir.
Bir də sual oluna bilər ki, almaz niyə yüksək ərimə nöqtəsinə malikdir? Hər bir karbon atomu dörd digər karbon atomu ilə kovalent bağlanır. Atomları ayırmaq üçün çoxlu enerji lazımdır almaz . Bunun səbəbi kovalent bağların güclü olmasıdır və almaz çoxlu kovalent bağlar ehtiva edir. Bu edir almazın ərimə nöqtəsi və qaynama nöqtəsi çox yüksək.
Buna görə qrafitin ərimə nöqtəsi niyə yüksəkdir?
Bununla belə, qrafit hələ çox var yüksək ərimə və qaynama nöqtəsi çünki karbon atomlarını təbəqələrdə bir arada saxlayan güclü kovalent bağlar qırılmaq üçün çoxlu istilik enerjisi tələb edir.
Niyə almazın ərimə nöqtəsi natrium xloriddən yüksəkdir?
İçindəki istiqrazlar natrium xlor kifayət qədər güclü ion bağlarıdır və buna görə də kifayət qədər yüksəkdir ərimə nöqtəsi 801C. Bunlar çox güclü bağlardır və s almaz (və qrafit) asan deyil ərimiş . Əslində bu maddələr yoxdur ərimək lakin ülvi (qaz halında karbon atomlarına çevrilir).
Tövsiyə:
Niyə qələvi metalların aşağı ərimə nöqtəsi var?

Qələvi metalların ərimə və qaynama nöqtələri daha aşağıdır. Bu elektron digər elementlərin əksər atomlarına nisbətən nüvədən daha da uzaqlaşa bilir. Artan atom radiusu atomlar arasında daha zəif qüvvələr deməkdir və beləliklə daha aşağı ərimə və qaynama nöqtəsi
Niyə təmiz maddənin daha yüksək ərimə nöqtəsi var?

Molekullararası qüvvələrin rolu Maddə əriyəndə bu qüvvələr pozulmalıdır ki, bu da enerjinin daxil olmasını tələb edir. Enerjinin daxil edilməsi yüksək temperatura çevrilir. Beləliklə, bərki birləşdirən qüvvələr nə qədər güclü olarsa, onun ərimə nöqtəsi bir o qədər yüksək olar
Niyə etil spirtinin qaynama nöqtəsi metil spirtindən daha yüksəkdir?

Etanol metanoldan daha yüksək qaynama nöqtəsinə malikdir. Beləliklə, molekullararası qüvvələri aradan qaldırmaq üçün daha çox enerji tələb olunur, nəticədə qaynama/ərimə nöqtələri artır
Niyə suyun yüksək ərimə nöqtəsi var?
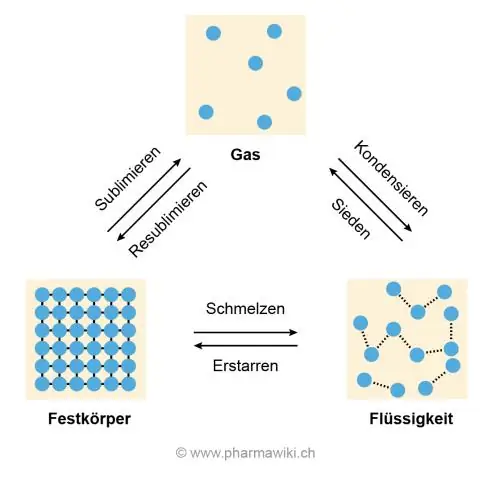
Yüksək ərimə və qaynama temperaturlarının səbəbi, su molekulları arasındakı hidrogen bağıdır ki, bu da onların bir-birinə yapışmasına və bir-birindən ayrılmağa müqavimət göstərməsinə səbəb olur, bu da buz əridikdə və su qaynadıqda qaza çevrildikdə baş verir
Niyə alüminiumun ərimə nöqtəsi natriumdan daha yüksəkdir?

Dövr ərzində valentlik artır (natriumda valentlik 1-dən alüminiumda valentlik 3-ə qədər), beləliklə, metal atomları daha çox müsbət yüklü kationlar və daha böyük delokallaşdırılmış elektron dənizi yaratmaq üçün daha çox elektron delokalizasiya edə bilər. Beləliklə, metal bağ daha güclü olur və ərimə nöqtəsi natriumdan alüminiuma qədər artır
